Eritoidu märgistamise erinõuded
SISUKORD
Sissejuhatus
Eritoiduks nimetatakse toitu, mis on mõeldud tavapärasest erinevate toitumisvajadustega inimestele ning mis on seetõttu valmistatud eritehnoloogia abil või millel on tavatoidust erinev koostis.
Eritoidu hulka kuuluvad järgmised toidugrupid:
- imiku piimasegu ja jätkupiimasegu,
- imiku- ja väikelapsetoit,
- meditsiinilisel näidustusel kasutamiseks ettenähtud toit,
- kehakaalu alandamiseks ettenähtud päevase toidu asendaja.
Käsiraamatus käsitleme eritoidu peatükis ka toite, mille laktoosi- või gluteenisisaldust on vähendatud.
Imiku piimasegu ja jätkupiimasegu
Määratlused
Euroopa Parlamendi ja nõukogu määrus (EL) nr 609/2013, 12. juuni 2013 , imikute ja väikelaste toidu, meditsiinilisel näidustusel kasutamiseks ettenähtud toidu ning kehakaalu alandamiseks ettenähtud päevase toidu asendajate kohta
Komisjoni delegeeritud määrus (EL) 2016/127, 25. september 2015, millega täiendatakse Euroopa Parlamendi ja nõukogu määrust (EL) nr 609/2013 seoses imiku piimasegu ja jätkupiimasegu koostise ja teabe erinõuetega ning teabega imikute ja väikelaste toitmise kohta
Kuni 21. veebruarini 2022 reguleerib valgu hüdrolüsaatidel põhinevat imiku piimasegu ja jätkupiimasegu maaeluministri 11.07.2016 määrus nr 43 „Eritoidu koostis- ja kvaliteedinõuded, selle valmistamiseks kasutatavate ainete ja selle käitlemise nõuded ning eritoidu kohta toidualase teabe esitamise nõuded“.
Imiku piimasegu on imikutele esimestel elukuudel ettenähtud toit, mis rahuldab ainsa toiduallikana nende toitumisvajadusi kuni sobiva lisatoidu kasutuselevõtmiseni.
Jätkupiimasegu on imikutele pärast sobiva lisatoidu kasutuselevõtmist ettenähtud toit, mis on imikute peamiseks vedelikuallikaks järk-järgult mitmekesisemaks muutuvas toiduvalikus.
Imik on alla 12 kuu vanune laps.
Imiku piimasegude ja jätkupiimasegude nimetused on sätestatud määruse (EL) 2016/217 VI lisa A ja B osades. Täielikult lehmapiima- või kitsepiimavalgust toodetud imiku piimasegu ja jätkupiimasegu nimetus on „Piimal põhinev imiku piimasegu“ ja „Piimal põhinev jätkupiimasegu“. Muude imiku piimasegude ja jätkupiimasegude nimetus on „Imiku piimasegu“ ja „Jätkupiimasegu“.
Kuni 21. veebruarini 2022 reguleerib valgu hüdrolüsaatidel põhineva imiku piimasegu ja jätkupiimasegu märgistamist maaeluministri 11.07.2016 määrus nr 43. Sisu poolest on nõuded samad kui allpool kirjeldatud komisjoni delegeeritud määruse (EL) 2016/127 nõuded. Siiski tuleks kuni ELi määruse täieliku kohaldumiseni nende toodete märgistamise kohta vaadata ka riigisisese määruse nõudeid.
Teabe esitamise põhimõtted
Imiku piimasegu ja jätkupiimasegu märgistamine, esitlemine ja reklaam tuleb vormistada viisil, mis ei pärsi rinnaga toitmist. Vajalik teave toodete kasutamise kohta tuleb anda nii, et ei alahinnataks rinnaga toitmise olulisust. Seega ei tohi kasutada väljendeid „rinnapiimasarnane“, „emapiimasarnane“, „kohandatud“ vms.
Imiku piimasegu märgistamisel, esitlemisel ja reklaamimisel ning jätkupiimasegu märgistamisel ei kasutata imikute pilte ega muid pilte või teksti, mis võiksid sellise piimasegu kasutamist idealiseerida. Lubatud on kasutada jooniseid imiku piimasegu ja jätkupiimasegu äratundmise hõlbustamiseks ja valmistamisviiside illustreerimiseks.
Imiku piimasegu ja jätkupiimasegu märgistus, esitlemine ja reklaam peab eelkõige teksti, pildi ja värvide kasutuse poolest olema kujundatud nii, et hoitakse ära imiku piimasegu ja jätkupiimasegu segiajamise oht ja võimaldatakse tarbijal neil selgelt vahet teha.

Lae alla PDF-ina
Teabe esitamise erinõuded
Imiku piimasegu korral tuleb järgida toidu märgistamise üldnõudeid ja esitada alljärgnev lisateave:
- märge selle kohta, et toode sobib imikute toiduks nende sünnist alates, kui neid ei toideta rinnaga;
- toote valmistamise, säilitamise ja kõrvaldamise juhised ning hoiatus, et valest valmistamisest ja säilitamisest tuleneb oht tervisele;
- rinnaga toitmise eelistele osutav teave ja soovitus kasutada toodet ainult meditsiini, toitumise või farmaatsia valdkonnas kvalifitseeritud sõltumatute asjatundjate või muude ema ja lapse hooldamise eest vastutavate isikute nõuandel. Selle lisateabe ette tuleb märkida sõnad „Pane tähele“ või muu samatähenduslik viide, mis tuleb esitada ka imiku piimasegu esitlemisel ja reklaamimisel.
Jätkupiimasegu korral tuleb järgida toidu märgistamise üldnõudeid ja esitada alljärgnev lisateave:
- märge, et toode sobib ainult üle kuue kuu vanuste imikute toiduks, et see peaks olema vaid mitmekülgse toiduvaliku osa, et see ei sobi esimesel kuuel elukuul kasutamiseks rinnapiimaasendajana ning et otsus alustada lisatoitmisega, kaasa arvatud kuue kuu vanusepiirist tehtavate erandite korral, tuleks teha ainult meditsiini, toitumise või farmaatsia valdkonnas kvalifitseeritud sõltumatute asjatundjate või muude ema ja lapse hooldamise eest vastutavate isikute nõuandel, ning selline otsus peab lähtuma iga imiku kasvu- ja arenguvajaduste eripärast;
- toote valmistamise, säilitamise ja kõrvaldamise juhised ning hoiatus, et valest valmistamisest ja säilitamisest tuleneb oht tervisele.
Ülaltoodud lisateabe esitamisel tuleb järgida üldist tähemärgisuuruse nõuet. Teave trükitakse tähtedes, mille tähemärgisuuruse x-kõrgus on vähemalt 1,2 mm. Pakendite või mahutite korral, mille suurima külje pindala on väiksem kui 80 cm2, on tähemärgi kohustuslik x‑kõrgus vähemalt 0,9 mm. Vaata täpsemalt ka alapeatükist „Tähemärgisuurus“.
Toitumisalase teabe esitamise erinõuded
Toitumisalane teave on kohustuslik kõikide imiku piimasegude ja jätkupiimasegude puhul, olenemata sellest, millised on pakendi või mahuti suurima külje mõõtmed.
Tavatoidu korral esitatakse toitumisalane teave alljärgnevalt.
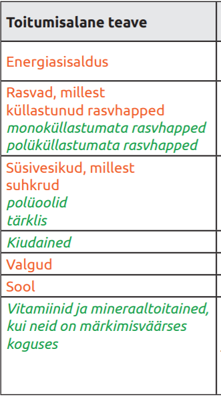
| Toitumisalases teabes peab esitama energiasisalduse, rasvade, küllastunud rasvhapete, süsivesikute, suhkrute, valkude ja soola kogused. |
Lisaks võib esitada monoküllastumata rasvhapete, polüküllastumata rasvhapete, polüoolide, tärklise, kiudainete, vitamiinide, ja mineraalainete kogused. |
Imiku piimasegu ja jätkupiimasegu korral peab kohustuslikus toitumisalases teabes esitama ka iga määruse (EL) 2016/127 I ja II lisas nimetatud mineraalaine ja vitamiini, välja arvatud molübdeeni koguse tootes. Erandina ei pea imiku piimasegu ja jätkupiimasegu toitumisalases teabes esitama soola kogust. Imiku piimasegu korral tuleb lisaks esitada koliini, inositooli ja karnitiini kogused.
Kohustuslikku toitumisalast teavet võib peale monoküllastumata rasvhapete, polüküllastumata rasvhapete, polüoolide, tärklise ja kiudainete koguste täiendada ühe või mitme alljärgneva aine sisaldusi käsitleva teabega:
- valgu-, süsivesiku- või rasvakomponentide kogused;
- vadakuvalgu/kaseiini suhtarv;
- määruse (EL) 2016/127 I või II lisas või määruse (EL) nr 609/2013 lisas loetletud mis tahes aine kogus, kui selle märkimine ei ole hõlmatud kohustuslikus toitumisalases teabes;
- kõikide tootele lisatud ainete kogused.
Erinevalt muudest toitudest ei ole imiku piimasegu ja jätkupiimasegu pakendi esiküljel lubatud toitumisalast teavet korrata.
Nende toodete puhul ei esitata energiasisaldust ja toitainete kogust protsendina määruse (EL) nr 1169/2011 XIII lisas sätestatud võrdluskogustest.
Energiasisaldus ja toitainete kogus esitatakse 100 ml tootja juhendi kohaselt valmistatud tarbimisvalmis toidu kohta. Andmed võib esitada ka 100 g müüdava toote kohta. Lisaks võib jätkupiimasegu puhul määruse (EL) 2016/127 VII lisas loetletud vitamiinide ja mineraalainete kogused märkida protsendina kõnealuses lisas sätestatud võrdluskogustest 100 ml tootja juhendi kohaselt valmistatud tarbimisvalmis toidu kohta.
Tavatoidu toitumisalaste teabe järjestus on määruse (EL) nr 1169/2011 XV lisa kohaselt järgnev:
Imiku piimasegu ja jätkupiimasegu kohta esitatavad toitumisalased andmed, mida ei ole ülal loetletud, märgitakse pärast kõige asjakohasemat kannet, mille alla need kuuluvad või mille osa need on. Andmed, mis ei kuulu ühegi kande alla ega ole osa ühestki esitatud kandest, märgitakse toitumisalase teabe lõppu.
Väidete ja teatud märgete esitamine
Imiku piimasegu kohta ei tohi esitada toitumis- ega tervisealaseid väiteid.
Märke „ainult laktoos“ võib imiku piimasegu ja jätkupiimasegu kohta esitada tingimusel, et laktoos on ainus tootes olev süsivesik.
Märke „laktoosivaba“ võib imiku piimasegu ja jätkupiimasegu kohta esitada tingimusel, et toote laktoosisisaldus on alla 2,5 mg/100 kJ (10 mg/100 kcal).
Kui märge „laktoosivaba“ esitatakse muudest valguallikatest kui sojavalgu isolaatidest toodetud imiku piimasegu ja jätkupiimasegu kohta, tuleb sellele lisada teave „ei sobi imikutele, kellel on galaktoseemia“. See lisateave esitatakse märke „laktoosivaba“ lähedal ning sellega sama suures kirjas ja sama hästi nähtavalt.
Märke „sisaldab dokosaheksaeenhapet (nagu on õigusaktidega ette nähtud kõikide imiku piimasegude puhul)“ või „sisaldab DHAd (nagu on õigusaktidega ette nähtud kõikide imiku piimasegude puhul)“ võib esitada ainult enne 22. veebruari 2025. a turule lastud imiku piimasegu kohta.
Teabe esitamine gluteeni puudumise või vähendatud sisalduse kohta imiku piimasegudes ja jätkupiimasegudes on keelatud.
Imiku- ja väikelapsetoit
Toitumisalase teabe esitamise erinõuded
Euroopa Parlamendi ja nõukogu määrus (EL) nr 609/2013, 12. juuni 2013 , imikute ja väikelaste toidu, meditsiinilisel näidustusel kasutamiseks ettenähtud toidu ning kehakaalu alandamiseks ettenähtud päevase toidu asendajate kohta
Maaeluministri 11.07.2016 määrus nr 43 „Eritoidu koostis- ja kvaliteedinõuded, selle valmistamiseks kasutatavate ainete ja selle käitlemise nõuded ning eritoidu kohta toidualase teabe esitamise nõuded“
Imiku- ja väikelapsetoit jaotatakse kahte suurde rühma – teraviljapõhine töödeldud toit ja muu imikutoit.
Teraviljapõhine töödeldud toit on ette nähtud tervete imikute eritoitumisvajaduste rahuldamiseks võõrutusperioodil ja tervete väikelaste lisatoiduks ja/või nende järkjärguliseks kohanemiseks tavatoiduga. Teraviljapõhised töödeldud toidud jaotatakse alljärgnevatesse rühmadesse:
- lihtsad teraviljatoidud, mille valmistamiseks on lisatud või tuleb lisada piima või muid sobivaid vedelikke;
- teraviljatoidud, millele on lisatud suure valgusisaldusega toitu ja mille valmistamiseks on lisatud või tuleb lisada vett või muud valguvaba vedelikku;
- pastatooted, mida tarvitatakse pärast vees või muus sobivas vedelikus keetmist;
- kuivikud ja küpsised, mida tarvitatakse kas valmiskujul või peenestatuna koos vee, piima või muu sobiva vedelikuga.
Muu imikutoit on ette nähtud tervete imikute eritoitumisvajaduste rahuldamiseks võõrutusperioodil ja tervete väikelaste lisatoiduks ja/või nende järkjärguliseks kohanemiseks tavatoiduga. See ei hõlma teraviljapõhist töödeldud toitu ning piimal põhinevad jooke ja sarnaseid väikelastele ettenähtud tooteid.
Imik on alla 12 kuu vanune laps. Väikelaps on 1-3 aastane laps.
Teabe esitamise erinõuded
Imiku- ja väikelapsetoidu korral tuleb järgida toidu märgistamise üldnõudeid ja esitada alljärgnev lisateave:
- millises vanuses imikule või väikelapsele toode on ette nähtud, kusjuures toode ei tohi olla ette nähtud alla nelja kuu vanusele imikule;
- gluteenisisaldus või märge gluteeni puudumise kohta alla kuue kuu vanusele imikule ettenähtud toidu puhul;
- kohustuslik toitumisalane teave 100 g või 100 ml kohta ning vajaduse korral tarvitamiseks soovitatud toidukoguse kohta;
- nende mineraalainete ja vitamiinide, mille kohta on määruses sätestatud sisalduse nõue, keskmine kogus 100 g või 100 ml kohta ning vajaduse korral tarvitamiseks soovitatud toidukoguse kohta;
- vajaduse korral toidu tarvitamisjuhis ning märge tarvitamisjuhise järgimise vajalikkuse kohta.
Üle nelja kuu vanusele imikule ettenähtud imiku- ja väikelapsetoidu müügipakendi märgistusel võib olla teave, et see on sobiv kasutamiseks imikule alates nelja kuu vanusest juhul, kui sõltumatud meditsiini-, toitumis- või farmaatsiaalase haridusega spetsialistid ei soovita teisiti.
Lisaks võib imiku- ja väikelapsetoidu müügipakendi märgistusel esitada alljärgnevaid andmeid:
- maaeluministri 11.07.2016 määruse nr 43 imiku- ja väikelapsetoitu käsitleva peatüki 2. jaos nimetatud toitainete keskmine kogus 100 g või 100 ml kohta ning vajaduse korral tarvitamiseks soovitatud toidukoguse kohta, kui see ei ole juba hõlmatud kohustuslikus toitumisalases teabes;
- sama määruse lisas 6 nimetatud vitamiinide ja mineraalainete sisaldus väljendatuna protsendina võrdluskogusest 100 g või 100 ml toote kohta ja vajaduse korral tarvitamiseks soovitatud toidukoguse kohta, kui vitamiini või mineraalaine sisaldus on vähemalt 15% nimetatud võrdluskogusest.
Kehakaalu alandamiseks ettenähtud päevase toidu asendaja
Määratlused
Euroopa Parlamendi ja nõukogu määrus (EL) nr 609/2013 , 12. juuni 2013 , imikute ja väikelaste toidu, meditsiinilisel näidustusel kasutamiseks ettenähtud toidu ning kehakaalu alandamiseks ettenähtud päevase toidu asendajate kohta
Maaeluministri 11.07.2016 määrus nr 43 „Eritoidu koostis- ja kvaliteedinõuded, selle valmistamiseks kasutatavate ainete ja selle käitlemise nõuded ning eritoidu kohta toidualase teabe esitamise nõuded“
Kehakaalu alandamiseks ettenähtud päevase toidu asendaja on toit, mis on spetsiaalselt ette nähtud kehakaalu alandamiseks vähendatud energiasisaldusega toitumise korral ja millega asendatakse toidukäitleja juhiste kohasel kasutamisel kogu päevane toit. Selliste toodete puhul tuleb kasutada nimetust „Päevase toidu asendaja kehakaalu alandamise eesmärgil“.
Siin peatükis nimetatud erinõuded ei kehti toodete kohta, mida turustatakse ühe või mitme toidukorra asendajana. Sellised tooted kuuluvad aga toitumis- ja tervisealaseid väiteid reguleeriva Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 1924/2006 kohaldamisalasse. Nimelt kuuluvad lubatud tervisealaste väidete loetellu väited, mida võib kasutada toidugruppi „Toidukorra toidu asendaja kehakaalu alandamise eesmärgil“ kuuluvatel toodetel, kui on täidetud väite esitamise tingimused. Need väited on lisatud lubatud väidete loetellu komisjoni määrusega (EL) nr 2016/1413.
Teabe esitamise erinõuded
Kehakaalu alandamiseks ettenähtud päevase toidu asendaja korral tuleb järgida toidu märgistamise üldnõudeid ja alljärgnevaid erinõudeid:
- viidata ei tohi sellise toidu tarbimise tulemusena saavutatavale kehakaalu vähenemise määrale;
- kohustuslik toitumisalane teave esitatakse numbritega tarvitamiseks soovitatud valmistoidu koguse kohta;
- maaeluministri 11.07.2016 määruse nr 43 lisas 8 nimetatud vitamiinide ja mineraalainete keskmine sisaldus esitatakse numbritega tarvitamiseks soovitatud valmistoidu koguse kohta;
- vajaduse korral esitatakse toidu tarvitamisjuhis ning märge tarvitamisjuhise järgimise vajalikkuse kohta;
- märge toidu võimaliku lahtistava toime kohta esitatakse siis, kui tarvitamisjuhise kohaselt valmistatud toit sisaldab päevase toidu koguse kohta üle 20 g polüoole;
- esitatakse märge päevase vajaliku vedelikuhulga tarbimise tähtsuse kohta;
- esitatakse märge selle kohta, et see toit sisaldab kõiki vajalikke toitaineid päevases vajalikus koguses ja seda ei tohi tarbida arsti soovituseta järjest üle kolme nädala.
Meditsiinilisel näidustusel kasutamiseks ettenähtud toit
Määratlused
Euroopa Parlamendi ja nõukogu määrus (EL) nr 609/2013 , 12. juuni 2013 , imikute ja väikelaste toidu, meditsiinilisel näidustusel kasutamiseks ettenähtud toidu ning kehakaalu alandamiseks ettenähtud päevase toidu asendajate kohta
Komisjoni delegeeritud määrus (EL) 2016/128, 25. september 2015, millega täiendatakse Euroopa Parlamendi ja nõukogu määrust (EL) nr 609/2013 seoses meditsiinilisel näidustusel kasutamiseks ettenähtud toidu koostise ja teabe erinõuetega
Komisjoni teatis meditsiinilisel näidustusel kasutamiseks ettenähtud toidu liigitamise kohta (2017/C 401/01)
Meditsiinilisel näidustusel kasutamiseks ettenähtud toit on eriliselt töödeldud või erilise koostisega toit, mis on ette nähtud patsientide (sh imikute) toitainevajaduste rahuldamiseks ja mida kasutatakse meditsiinilise järelevalve all. See on toit, mis on ette nähtud täielikuks või osaliseks toitumiseks patsientidele, kellel on piiratud, kahjustunud või häirunud võime tavatoidu või teatavate selles sisalduvate toitainete või metaboliitide manustamiseks, seedimiseks, imendumiseks, metaboliseerimiseks või eritamiseks või kellel on muud meditsiiniliselt kindlaks tehtud toitumisvajadused, mille rahuldamist ei ole võimalik tagada üksnes tavatoitumise muutmisega.
Meditsiinilisel näidustusel kasutamiseks ettenähtud toidu nimetused on sätestatud määruse (EL) 2016/128 IV lisas. Eesti keeles tuleb kasutada nimetust „Meditsiinilisel näidustusel kasutamiseks ettenähtud toit“.
Teabe esitamise erinõuded
Meditsiinilisel näidustusel kasutamiseks ettenähtud toidu korral tuleb järgida toidu märgistamise üldnõudeid ja esitada alljärgnev lisateave:
- teave, et toodet tuleb kasutada meditsiinilise järelevalve all*;
- märge selle kohta, kas toode sobib kasutamiseks ainsa toitaineallikana*;
- vajaduse korral märge selle kohta, et toode on ette nähtud teatavale vanuserühmale*;
- vajaduse korral esitatakse teave, et toode võib olla tervisele ohtlik, kui seda tarvitavad isikud, kellel ei ole haigust ega terviseseisundit, mille puhul kõnealune toode on ette nähtud*;
- märge „Dieetraviks … korral“, kus lünka kirjutatakse haigus, tervisehäire või terviseseisund, mille puhul toode on ette nähtud;
- omaduste kirjeldus, mis muudavad toote kasulikuks sellise haiguse või terviseseisundi puhul, mille jaoks see on ette nähtud. Eelkõige kirjeldatakse selliseid omadusi nagu eritöötlus, eriline koostis, toitainete hulga suurendamine või vähendamine, toitaine eemaldamine või muutmine ning toote kasutamise põhjendus;
- toote valmistamise, kasutamise ja pakendi avamisele järgneva säilitamise juhised;
- vajaduse korral hoiatused ja teave vastunäidustuste kohta;
- vajaduse korral hoiatus, et toode ei ole ette nähtud parenteraalseks kasutamiseks.
* Esimeses neljas alapunktis osutatud teabe ette tuleb märkida sõnad „Pane tähele“ või muu samatähenduslik viide.
Ülaltoodud lisateabe esitamisel tuleb järgida üldist tähemärgisuuruse nõuet. Teave trükitakse tähtedes, mille tähemärgisuuruse x-kõrgus on vähemalt 1,2 mm. Pakendite või mahutite korral, mille suurima külje pindala on väiksem kui 80 cm2, on tähemärgi kohustuslik x‑kõrgus vähemalt 0,9 mm. Vaata täpsemalt ka alapeatükist „Tähemärgisuurus“.
Toitumisalase teabe esitamise erinõuded
Toitumisalane teave on kohustuslik kõikide meditsiinilisel näidustusel kasutamiseks ettenähtud toitude korral, olenemata sellest, millised on pakendi või mahuti suurima külje mõõtmed.
Tavatoidu puhul esitatakse toitumisalane teave alljärgnevalt.
| Toitumisalases teabes peab esitama energiasisalduse, rasvade, küllastunud rasvhapete, süsivesikute, suhkrute, valkude ja soola kogused. |
Lisaks võib esitada monoküllastumata rasvhapete, polüküllastumata rasvhapete, polüoolide, tärklise, kiudainete, vitamiinide, ja mineraalainete kogused. |
Meditsiinilisel näidustusel kasutamiseks ettenähtud toidu kohustuslikus toitumisalases teabes tuleb esitada ka:
- iga määruse (EL) 2016/128 I lisas nimetatud mineraalaine ja vitamiini kogus tootes;
- sellised valgu, süsivesiku, rasva ja/või muude toitainete ja nende komponentide kogused, millest teavitamine on toote õige kasutuse tagamiseks vajalik;
- vajaduse korral teave toote osmolaalsuse või osmolaarsuse kohta;
- teave tootes sisalduvate valkude ja/või valguhüdrolüsaatide päritolu ja omaduste kohta.
Erinevalt muudest toitudest ei ole meditsiinilisel näidustusel kasutamiseks ettenähtud toidu pakendi esiküljel lubatud toitumisalast teavet korrata.
Energiasisaldus ja toitainete kogus esitatakse müüdava toidu kohta ja vajaduse korral tootja juhiste kohaselt valmistatud tarvitamiseks valmis toidu kohta.
Nende toodete puhul ei esitata energiasisaldust ja toitainete kogust protsendina määruse (EL) nr 1169/2011 XIII lisas sätestatud võrdluskogustest.
Tavatoidu toitumisalaste teabe järjestus on määruse (EL) nr 1169/2011 XV lisa kohaselt järgnev:

Meditsiinilisel näidustusel kasutamiseks ettenähtud toidu kohta esitatavad toitumisalased andmed, mida ei ole ülal loetletud, märgitakse pärast kõige asjakohasemat kannet, mille alla need kuuluvad või mille osa need on. Andmed, mis ei kuulu ühegi kande alla ega ole osa ühestki esitatud kandest, märgitakse toitumisalase teabe lõppu.
Naatriumikogus tuleb märkida koos muude mineraalainetega ja seda võib korrata soolasisalduse kõrval järgmiselt: „Sool: X g (millest naatriumi: Y mg)“.
Väidete esitamine
Meditsiinilisel näidustusel kasutamiseks ettenähtud toidu kohta ei tohi esitada toitumis- ega tervisealaseid väiteid.
Imikute toit
Komisjoni delegeeritud määruses (EL) nr 2016/128 on kehtestatud erinõuded imikutele mõeldud meditsiinilisel näidustusel kasutamiseks ettenähtud toidu märgistamise, esitlemise ja reklaami kohta. Need nõuded sarnanevad tervetele imikutele ettenähtud piimasegu ja jätkupiimasegu kohta kehtestatud nõuetega.
Meditsiinilisel näidustusel imikute toitmiseks ettenähtud toidu märgistamisel, esitlemisel ja reklaamimisel ei kasutata imikute pilte või muid pilte või teksti, mis võiksid toote kasutamist idealiseerida. Märgistusel võivad siiski olla joonised toote äratundmise hõlbustamiseks ja valmistamisviiside illustreerimiseks.
Selliste toitude märgistus, esitlus ja reklaam peab eelkõige teksti, pildi ja värvide kasutuse poolest olema kujundatud nii, et võimaldab tarbijal selgelt vahet teha meditsiinilisel näidustusel kasutatava toidu ning imiku piimasegu ja jätkupiimasegu vahel, et hoida ära võimalik vääritimõistmine.
Gluteenisisaldusele viitavad märked
Komisjoni rakendusmäärus (EL) nr 828/2014, 30. juuli 2014, milles käsitletakse tarbijatele esitatava teabe nõudeid gluteeni puudumise või vähendatud sisalduse kohta toidus
Lubatud on üksnes alltoodud väljendid gluteeni puudumise või vähendatud sisalduse kohta.
„Gluteenivaba“ – võib kasutada toidu puhul, mille gluteenisisaldus ei ole suurem kui 20 mg/kg.
„Väga väikese gluteenisisaldusega“ – võib kasutada toidu puhul,
- mille gluteenisisaldus ei ole suurem kui 100 mg/kg ja
- mis sisaldab ainult või muu hulgas ühte või mitut nisust, rukkist, odrast, kaerast või nende ristanditest valmistatud koostisosa, mida on gluteenisisalduse vähendamiseks spetsiaalselt töödeldud.
Kaer, mis sisaldub märkega „gluteenivaba“ või „väga väikese gluteenisisaldusega“ turustatavas toidus, peab olema spetsiaalselt toodetud, valmistatud ja/või töödeldud nii, et oleks välditud saastumine nisu, rukki, odra või nende ristanditega. Sellise kaera gluteenisisaldus ei tohi olla suurem kui 20 mg/kg.
Ülaltoodud väljendeid ei tohi asendada muude sarnaste väljenditega. Näiteks väljendi „gluteenivaba“ asemel ei tohi öelda „ei sisalda gluteeni“, kasutada ei tohi väljendit „vähendatud gluteenisisaldusega“, „väikese gluteenisisaldusega“ vms. Väljendit „gluteenivaba“ ei ole lubatud kasutada juhul, kui kõik samalaadsed toidud on gluteenivabad (nt puu- ja köögiviljad).
Väljenditele „gluteenivaba“ ja „väga väikese gluteenisisaldusega“ võib lisada väljendeid:
- „sobib gluteenitalumatusega inimestele“ või „sobib tsöliaakiahaigetele“;
- „spetsiaalselt valmistatud gluteenitalumatusega inimestele“ või „spetsiaalselt valmistatud tsöliaakiahaigetele“ juhul, kui see toit on spetsiaalselt toodetud, valmistatud ja/või töödeldud nii, et vähendada ühe või mitme gluteeni sisaldava koostisosa gluteenisisaldust või asendada gluteeni sisaldavad koostisosad looduslikult gluteenivabade koostisosadega.
Teabe esitamine gluteeni puudumise või vähendatud sisalduse kohta imiku piimasegudes ja jätkupiimasegudes on keelatud, sest nende valmistamisel on gluteeni sisaldavate koostisosade kasutamine keelatud. Alla kuue kuu vanusele imikule ettenähtud toidu puhul on aga kohustuslik esitada gluteenisisaldus või märge gluteeni puudumise kohta.
Gluteenivaba märgist (läbikriipsutatud viljapea) tohib kasutada vaid Eesti Tsöliaakia Seltsi väljastatud litsentsi alusel. Väljastatud märgis sisaldab ka registreerimisnumbrit. Märgise kasutamisõiguse saamiseks gluteenivabal toidul tuleb pöörduda Eesti Tsöliaakia Seltsi poole.

Lisamaterjalid:
Teabeleht „Gluteenivaba toit“ (Eesti Toiduainetööstuse Liit, 2019), vaata siit
Eesti Tsöliaakia Selts, vaata siit
Põllumajandus- ja Toiduameti veebilehel esitatud teave ja juhendid gluteenivaba toidu kohta, vaata siit
Laktoosisisaldusele viitavad märked
Märke „laktoosivaba“ kasutamine on õigusaktidega reguleeritud vaid piimasegude puhul. Märke „laktoosivaba“ võib imiku piimasegu ja jätkupiimasegu kohta esitada tingimusel, et toote laktoosisisaldus on alla 2,5 mg/100 kJ (10 mg/100 kcal).
Muude toitude korral lähtutakse Eestis hetkel Põhjamaade ekspertide aruandest, mille kohaselt saab kasutada teavet:
- „laktoosivaba“, kui laktoosi sisaldus on alla 10 mg 100 g või 100 ml toote kohta;
- „väikese/madala laktoosisisaldusega“, kui laktoosi sisaldus on alla 1 g 100 g või 100 ml toote kohta.
Märke „laktoosivaba“ kasutamine toitudel, mis ei saagi laktoosi sisaldada, on eksitav ja seega ei ole seda lubatud kasutada.
Viimati uuendatud: 3. august 2021